Věda a technika v pozadí
Teorie
Z povrchu vody se za každé teploty vypařuje vodní pára. Při snížení tlaku se také snižuje teplota varu, proto ve vodě začnou vznikat malé bublinky páry. Na vypařování a vznik bublinek páry je potřeba energie, která se odebere z vody. Tím se voda ochlazuje.
Tento proces probíhá tak dlouho, až se voda přemění na led. I teplota tuhnutí závisí na tlaku. U většiny látek klesá při snížení tlaku také teplota tuhnutí. Tyto látky také při tuhnutí zmenšují svůj objem. Např. relativní zvětšení objemu při tání olova je asi 3,4 %. Výjimkou je voda, která s klesajícím tlakem zvyšuje teplotu tuhnutí a zvyšuje objem. Např. u ledu činí relativní změna objemu asi 9 %. V puklině horniny zmrzlá voda zvětšením objemu vyvolá velké tlakové síly, které horninu roztrhnou (mrazová eroze).
Kus ledu je možno proříznout ocelovým drátem zatíženým závažím (tzv. regelace ledu). Led pod drátem taje, ale vzniklá voda hned tuhne, takže drát projde ledem, aniž jej rozdělí. Regelací vysvětlujeme plastičnost tajícího sněhu, který tlakem snadno přijímá různé tvary, pohyb ledovců apod. Stejná vlastnost ledu umožňuje bruslení. Díky tenké čepeli brusle působíme na led velkým tlakem, který snižuje teplotu tání ledu např. na –5 °C. Pod bruslí se vytvoří tenká vrstvička roztáté vody, po které snadno kloužeme.

Zdroj: commons.wikimedia.org. Public domain.
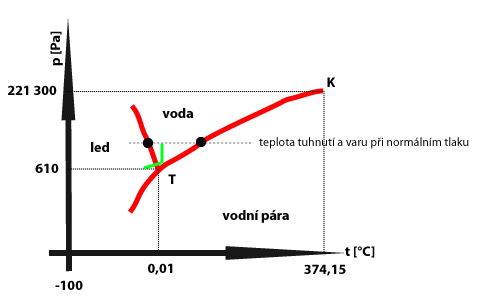
Rovnovážné stavy dané látky mezi různými skupenstvími můžeme znázornit do tzv. fázového diagramu. Fázový diagram se skládá ze tří křivek: křivka syté páry znázorňuje rovnovážné stavy mezi kapalinou a její sytou párou; křivka tání znázorňuje rovnovážný stav mezi pevným a kapalným tělesem téže látky, křivka není ukončena; křivka sublimační znázorňuje rovnovážný stav mezi pevným tělesem a sytou párou z téže látky.
Všechny tři křivky se stýkají v jednom bodě T, který nazýváme trojný bod. Znázorňuje rovnovážný stav soustavy pevné těleso + kapalina + sytá pára. Např. voda má základní teplotu 0,01 °C, helium nemá trojný bod. Teplota trojného bodu vody je základní teplota termodynamické teplotní stupnice. Bod K představuje hodnotu tlaku a teploty pro kritický stav, kdy není rozdíl mezi kapalinou a plynem. Pokusně ho zjistil Cagniard de la Tour. Význam tohoto bodu spočívá v tom, že přehřátou páru, jejíž teplota je nad kritickou teplotou nelze žádným způsobem zkapalnit. Přechod z jedné oblasti do druhé protnutím některé z křivek vždy znamená přechod z jednoho skupenství do druhého. Zelenou čárou je v obrázku přibližně znázorněn proces v exponátu.