Teorie
V druhé polovině 19. století se touto problematikou zabývalo více chemiků. Mendělejev byl však první, který našel solidní řešení. Není bez zajímavosti, že mu v tom pomohla pedagogická praxe. V roce 1869 byl řádným profesorem anorganické chemie na univerzitě v Petrohradě. Uvažoval o tom, jak by svým posluchačům co nejlépe vysvětlil souvislost mezi vlastnostmi chemických prvků a jejich atomovými hmotnostmi. V květnu 1869 na toto téma uveřejnil článek Vztah vlastností prvků k atomovým vahám, kde psal už o nutnosti objevu nových neznámých prvků, což se během další let potvrdilo. Sám Mendělejev v roce 1891 napsal: „Dosud nám chybí prostředky, abychom pochopili povahu a příčiny tohoto zákona. Podle všeho příčina tkví ve vnitřní mechanice atomů a molekul.“
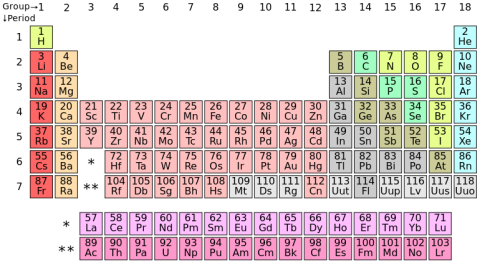
V roce 1869 odhalil Dmitrij Mendělejev vzájemné souvislosti mezi chemickými prvky, známými v jeho době a sestavil periodickou soustavu prvků. Řada prvků nebyla tehdy ještě známa, ale Mendělejev s tím počítal a ve své soustavě vynechal prázdná políčka tam, kde mu některý v logické posloupnosti chyběl. V průběhu dalších let byly postupnými objevy mezery vyplňovány a nakonec chyběl jen prvek s protonovým číslem 43. Bylo tedy známo celkem 91 prvků vyskytujících se v přírodě, počínaje vodíkem a konče uranem. Jeden z prvních cyklotronů postavil fyzik Emilio Segré na univerzitě v kalifornském Berkeley. V něm se v polovině 30. let pokusil ozařovat molybden (42) deuterony (jádry těžkého vodíku). Výsledkem pokusu byl nový, uměle vytvořený prvek, který dokonale zapadal do mezery pro atomové číslo 43. Dostal název technecium.
Od té doby byla vyrobena řada nových, umělých prvků, které začínají s protonovým číslem 93 (neptunium) a v současnosti končí někde u 120 protonů (prvek zatím bez jména). Tyto uměle vytvořené prvky označujeme jako transurany a většinou nemají žádné stabilní izotopy.
Základem uspořádání prvků v tabulce je seskupení elektronů v elektronovém obalu atomu. Ve skupinách nad sebou leží prvky se stejným počtem valenčních elektronů (tj. elektronů v poslední slupce). Přitom platí, že prvky, nacházející se ve společné skupině, vykazují i podobné chemické vlastnosti. Příkladem skupiny prvků jsou alkalické kovy, které (spolu s vodíkem) zaujímají místo v 1. skupině a mají vždy pouze jeden valenční elektron v poslední slupce. Jiným příkladem jsou halogeny, prvky nacházející se v 7. hlavní skupině prvků se sedmi valenčními elektrony.