Věda a technika v pozadí
Postav si tu nejkrásnější molekulu
Teorie
Jednotlivé části molekuly nebo jednotlivé atomy drží pohromadě síly, které se nazývají chemické vazby. Stabilita každého atomu závisí podle Johna von Neumanna na minimu vnitřní energie. Pevná látka tedy může existovat jen v tom případě, že její energie je nižší než energie izolovaných částic. Rozdíl obou energií se nazývá vazebná energie a tvoří ji přitažlivé a odpudivé síly elektrostatické (gravitační sílu můžeme vzhledem k její velikosti zanedbat). Vzhledem k tomu, že jsou pevné látky tvořeny atomy, je potřeba při jejich popisu počítat i s kvantově–mechanickými jevy.
Rozlišujeme čtyři základní vazby: van der Waalsova, kovalentní, kovová a iontová. U některých molekul nelze rozhodnout, o jakou vazbu se jedná, proto hovoříme o vazbě smíšené. Příkladem může být jód (vazba kovalentní a van der Waalsova), grafit (atomy uhlíku jsou vázány kovalentní vazbou v rovinách, kdežto tyto roviny jsou vázány van der Walsovou vazbou), krystaly Si, AlP, MgS, NaCl (vazba kovalentní a iontová).
Van der Waalsova vazba
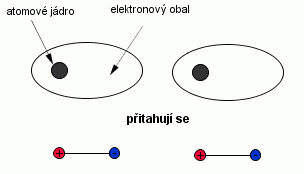
Van der Waalsovy přitažlivé síly působí mezi všemi atomy a molekulami. Protože je energie jejich vzájemného působení velmi malá (řádově 10 kJ/mol = 0,1 eV/atom), bývá většinou překryta jinou, silnější vazbou. Krystaly, ve kterých působí van der Waalsova vazba, se nazývají molekulární krystaly. V čistém stavu se s ní setkáváme u inertních plynů, u kapalin a tuhých látek. Pevné látky vázané touto vazbou jsou izolátory, vyznačují se nízkým indexem lomu, malou hodnotou relativní permitivity, nízkým bodem tání a varu.
Podstatou van der Waalsových sil je kvantověmechanický jev spočívající ve vzájemném elektrickém působení mezi dipóly. To jsou protáhlé útvary, nesoucí dva stejně velké opačné elektrické náboje na každém z obou konců.
Van der Waalsova vazba.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Atomy všech látek jsou obvykle elektricky neutrální, neboť elektrony jsou rozděleny symetricky kolem jádra. Všechny atomy však konají při teplotě větší než 0 K kmitavý pohyb, v jehož důsledku dojde ke vzniku okamžitých krátkodobých narušení elektrické symetrie elektronového obalu, takže z neutrálních atomů vzniknou malé dipóly. Ty se mohou vzájemně orientovat tak, že se přitahují, nebo odpuzují. Podrobné výpočty ukazují, že v případě přitahování je celková energie systému nižší, než v případě odpuzování. Dojde tedy přednostně ke vzniku přitažlivých sil mezi dipóly a tím ke vzniku pevné látky (nebo kapaliny). Energie přitažlivých sil těchto vazeb má krátký dosah a klesá se šestou mocninou vzdálenosti.
Iontová vazba
Atomy alkalických kovů (Li, Na, K, Rb, Cs, Fr) jsou charakterizovány tím, že mají v posledním orbitalu jediný valenční elektron, slabě vázaný k celému atomu. Naopak halogenům (F, Cl, Br, I, At) chybí v posledním orbitalu jeden elektron k tomu, aby byl zcela zaplněn. Opustí–li tedy valenční elektron atom alkalického kovu a přejde do elektronového obalu halogenu, z atomu se stane kladný iont. Naopak z halogenu se stane iont záporný, přičemž oba ionty mají elektronovou konfiguraci vzácných plynů (mají všechny orbity plně zaplněné elektrony). Výsledná vazba mezi oběma ionty je čistě elektrostatická a síly mezi nimi jsou dány Coulombovým zákonem. Vazebná energie iontových krystalů je řádu 103 kJ/mol (5 eV/iont), tedy asi o dva řády vyšší, než energie Van der Waalsovy vazby.
Vodíková vazba
Vodíkový atom může být vázán elektrostatickou vazbou k jiným prvkům jako je např. fluor, kyslík, dusík. Vytváří pak vazbu, kterou je možné považovat za variantu iontové vazby. Atom vodíku ztrácí svůj elektron na úkor jiného atomu a stává se prostým protonem. Vodíková vazba se uplatňuje při vytváření ledu, polymeraci nebo v některých biomolekulách.
Kovalentní vazba
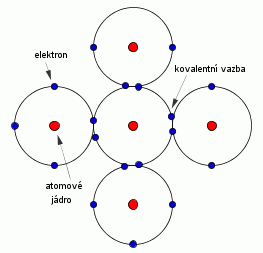
Kovalentní vazbou jsou vázány především polovodiče, projevuje se u nich silná závislost elektrického odporu na teplotě, mají relativně vysoký index lomu, velkou relativní permitivitu, bývají neprůhledné pro dlouhovlnné elektromagnetické záření. Podstatou kovalentní vazby je tzv. sdílení elektronů mezi sousedními atomy. Dva kovalentně vázané atomy přispívají každý nejméně jedním elektronem k vazbě a tyto elektrony jsou tedy „majetkem“ obou atomů.
Charakteristickou vlastností kovalentní vazby je již zmíněné sdílení elektronů, směrovost (kovalentní vazba se uskutečňuje pouze pod určitými úhly) a nasycenost (daná mocenstvím vázaných atomů). Je třeba poznamenat, že k úplnému pochopení kovalentní vazby nestačí názorné představy klasické fyziky. Dokonale ji lze objasnit pomocí kvantové mechaniky.
Kovalentní vazba je v přírodě velmi rozšířená. Váží se jí atomy nekovových prvků samy se sebou v molekuly (H2, Cl2, O2, atd.), stejně jako mezi sebou (CH4, H2O, HNO3, apod.). Patří sem ale rovněž diamant, krystal křemíku a germania a slitiny typu GaAs, InSb, atd. Kovalentní vazba bývá velmi silná (diamant taje až při teplotě 3550 °C), ale také mnohem slabší (vizmut taje již při 270 °C). Setkáme se s ní i při vzniku polymerů, kde umožňuje tvorbu dlouhých řetězců atomů a molekul.
Kovová vazba
Atomy kovových prvků mají jeden, dva nebo maximálně tři valenční elektrony. Model kovové vazby je založen na skutečnosti, že tyto elektrony, slabě k atomu vázané, nejsou vázány s žádným určitým atomem, ale jsou víceméně volné a pohybují se chaotickým pohybem v oblasti mezi kladnými ionty kovových atomů (které vznikly z neutrálních atomů poté, jak je elektrony opustily). Volné elektrony, nacházející se mezi těmito kladnými ionty jednak odstiňují jejich elektrostatické odpudivé síly a zároveň působí jako „lepidlo“, které je váže dohromady. Vazebná energie kovové vazby se pohybuje od 68 kJ mol–1 (0,7 eV/atom) pro rtuť (bod tání –39 °C) až po 850 kJ mol–1 (8,8 eV/atom) pro wolfram (bod tání 3410 °C).