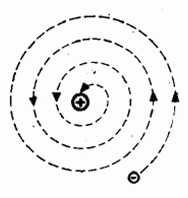
Dánský fyzik Niels Bohr použil v roce 1913 k vytvoření nového modelu atomu jednak představy Rutherfordovy, jednak představy Planckovy kvantové teorie a klasickou mechaniku, ale také spektroskopická měření, která prokázala, že spektrum záření je diskrétní a nikoli spojité, jak se podle planetárního modelu předpokládalo.
Aby mohl odstranit hlavní nedostatky Rutherfordova modelu, musel postulovat tzv. kvantovací podmínky, které nebylo možno získat ze základních zákonů klasické fyziky. Navrhl pro pohyb elektronu v atomu nové zákony. Elektrony se pohybují jen po kruhových drahách, pro které je splněna kvantovací podmínka
![]()
kde me je hmotnost elektronu, r poloměr kruhové dráhy a v je rychlost elektronu. Veličina n se označuje jako kvantové číslo a h je Planckova konstanta. Podle další podmínky, elektrony při pohybu po drahách splňujících kvantovací podmínku nevyzařují energii, energie může být vyzářena resp. přijata pouze za přechodu elektronu z jedné dráhy na druhou.
Bohr předpokládal, že na elektron působí dvě síly – odstředivá a elektrostatická popsaná Coulombovým zákonem. Tyto síly jsou stejně velké, opačně orientované.
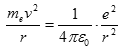
Zároveň použil kvantovací podmínku a z této soustavy rovnic s parametrem n vyjádřil podmínku pro poloměr dráhy elektronu r. Z kvantovací podmínky vyjádříme rychlost
![]()
a dosadíme do předchozí rovnice a vyjádříme poloměr kruhové dráhy (tzv. Bohrův poloměr)
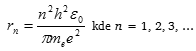
Různé dovolené dráhy znamenají různé energie elektronu. Energie elektronu určená pomocí orbitálního poloměru rn, která vychází z Rutherfordových výpočtů
![]()
a po dosazení Bohrova poloměru
![]()
zkráceně
![]()
Energie dané tímto vztahem se nazývají energetické hladiny vodíkového atomu. Tyto energie jsou všechny záporné, tzn. že elektron nemá dostatek energie, aby unikl z atomu. Ze vztahu je patrné, že hodnoty energie En se mění skokem a nikoli spojitě.
Pokud je elektron v kvantovém stavu určeném některým číslem n, nevyzařuje energii, takže energie atomu je stálá. Tento stav se proto označuje jako stacionární kvantový stav (základní stav) a příslušná energie se označuje jako energetická hladina. S rostoucím kvantovým číslem n, tj. se vzdalováním elektronu od jádra, roste jeho celková energie. Pro nejbližší energetickou hladinu (n = 1) vychází z kvantově mechanických výpočtů energie elektronu v atomu vodíku E1 = –K = –2,15 · 10–18 J = –13,53 eV (1 eV = 1,6 · 10–19 J). Znaménko minus ve vztahu pro energii a záporné hodnoty energie vyplývají z dohody, podle níž nulová energie byla přiřazena stavu, kdy jsou elektron a jádro od sebe tak daleko, že nemohou na sebe působit. Má–li se elektron dostat na vyšší hladinu, musí mu být dodána z vnějšku energie. Atom, který dodáním energie z vnějšku byl uveden na vyšší energetickou hladinu (do vyššího kvantového stavu), se označuje jako atom vzbuzený nebo excitovaný.
Poněvadž lze energii na n–té hladině v atomu vodíku vyjádřit vztahem
![]()
vychází pro jednotlivé hladiny energie
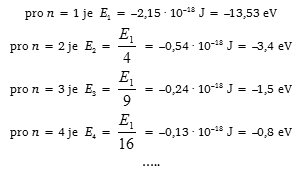
pro n → ∞ elektron již není v atomu vázán a energie E∞ → 0. Hladiny energie znázorňujeme v energetickém diagramu vodorovnými čarami.
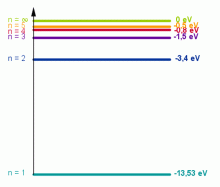
Diagram energetických hladin atomu vodíku.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Přeskočí–li elektron z excitovaného stavu do stavu nižšího, vyzáří se úbytek energie jako jeden jediný světelný foton. Existuje celá řada způsobů, jak zvýšit potenciální energii elektronů v atomu. Nejčastěji to bývá vzájemné silové působení atomu s částicí, od níž atom přejímá část její energie, tzv. interakce. Další způsob je vnějším působením, např. vysokou teplotou, vysokým napětím, rentgenovým zářením, radioaktivním zářením nebo letícími elektrony, ionty, atomy, molekulami apod. Tím se naruší rovnováha atomu. Přitom může dojít k ionizaci (elektron je z atomu odstraněn, takže atom už není neutrální, ale nese kladný elektrický náboj; je to kation) nebo excitaci – vzbuzení. Je–li vnější působení na atom nepostačující k ionizaci, pak se může stát, že některý elektron přejde z hladiny o nižší energii (blíže k jádru) na hladinu o vyšší energii (dále od jádra). V tomto stavu je atom vzbuzen a je schopen vyzařování – emise. Vzbuzený atom je nestabilní částicí s velmi krátkou dobou života (řádově 10–10 s). Velmi rychle se vrací do svého původního stabilního stavu. Potom energie vyzářené fotonu musí odpovídat rozdílu energií obou hladin
![]()
a po dosazení
![]()
a vyjádříme-li vlnovou délku
![]()
Což je vztah podobný vztahu odvozenému Balmerem. Stačí dokázat shodnost Rydbergovy konstanty a člene před závorkou v předchozí rovnici. Po dosazení
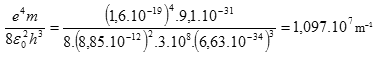
Což je stejná hodnota jako u Rydbergovy konstanty.
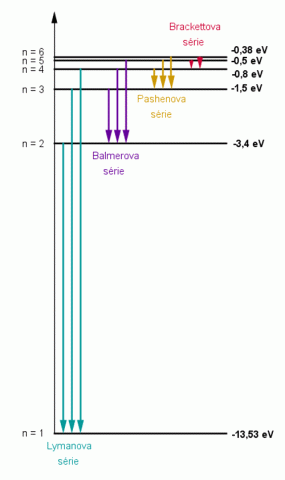
Vznik jednotlivých sérií ve spektru vodíku.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Nalezením vztahu pro kvantování energie nebyl Bohr ještě zcela spokojen. K úplnému popisu pohybu elektronu na stabilní dráze mu scházela ještě hybnost nebo spíš moment hybnosti, který představuje součin hybnosti elektronu a kolmé vzdálenosti elektronu od středu pohybu, tedy
![]()
Bohr dále uvažoval pohybující se elektron s kinetickou energií
![]()
a po dosazení do momentu hybnosti
![]()
Za kinetickou energii můžeme dosadit dříve odvozený vztah pro energii elektronu na hladině
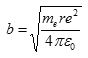
porovnáním dvou dříve odvozených vztahů po kinetickou energii
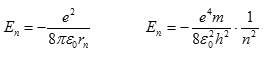
můžeme vztah pro hybnost upravit
![]()
Podle tohoto vztahu je elektron stabilní jen na těch drahách, kde je jeho moment hybnosti celistvým násobkem hodnoty h/2π. Často se tato konstanta označuje jako ħ (h s pruhem).
Tato teorie vypracovaná Nielsem Bohrem v roce 1913 souhlasí s experimenty provedenými Balmerem, Lymanem, Pashenem apod. Dokonce tato kvantová teorie dává stejné výsledky jako klasická fyzika v limitě velkých kvantových čísel. Tuto myšlenku Bohr nazval principem korespondence. Bohrova teorie přesně platí jen pro atom vodíku a ionty, které obsahují jen jeden elektron tedy pro He+ (ionizované helium), Li++ (dvakrát ionizované lithium). Naopak se nepodařilo aplikovat Bohrovu teorii ani na atom He.
Klasická fyzika se však neopírá jen o Newtonovu mechaniku, ale také o Maxwellovu elektrodynamiku. Podle této teorie elektrické náboje pohybující se se zrychlením vyzařují energii ve formě elektromagnetických vln. Stejně by to podle klasických představ muselo být i s elektronem pohybujícím se kolem kladně nabitého jádra. Vyzařování energie pohybujícími se náboji je podle klasické fyziky spojitý proces. Elektron by ztrácel energii, vzdálenost elektronu od jádra by se stále spojitě zmenšovala a po spirále by se přibližoval k jádru. Frekvence jeho oběhu by se rovněž spojitě měnila, spektrum atomu by nemohlo být čarové. Prostým výpočtem se dá zjistit, že elektron by měl spadnout do jádra za dobu kratší než je 10-10 sekundy, vodíkový atom by se zhroutil.