V normální konfiguraci atomu vodíku je elektron ve svém nejnižším kvantovém stavu. Jak ale vypadá v normální konfiguraci atom složitějšího prvku? V roce 1925 na tuto otázku odpověděl Wolfgang Pauli jednoduchým principem, kterému se podřizují elektrony ve složitějším atomech. Jeho vylučovací princip říká, že žádné dva elektrony v atomu nemohou existovat ve stejném kvantovém stavu. Každý elektron tedy musí mít jiná kvantová čísla n, l, m a ms.
Všechny elektrony se stejným hlavním kvantovým číslem n jsou v průměru zhruba ve stejné vzdálenosti od jádra a mají tudíž téměř stejnou energii. Obvykle se takovým elektronů říká, že obsazují stejnou atomovou slupku. Slupky se označují velkými písmeny
|
n = |
1 |
2 |
3 |
4 |
5 |
… |
|
|
K |
L |
M |
N |
O |
… |
Všechny elektrony ve slupce, které mají stejné kvantové číslo l, tvoří podslupku. Každá podslupka je udána hlavním kvantovým číslem n, za nímž následuje písmeno odpovídající orbitálnímu kvantovému čísla l podslupky. Horní index označuje počet elektronů v podslupce. Např. elektronová konfigurace sodíku 1s22s22p63s1, což znamená, že podslupky 1s (n = 1, l = 0) a 2s (n = 2, l = 0) obsahují po dvou elektronech, podslupka 2p (n = 2, l = 1) obsahuje šest elektronů a podslupka 3s (n = 3, l = 0) obsahuje jeden elektron.
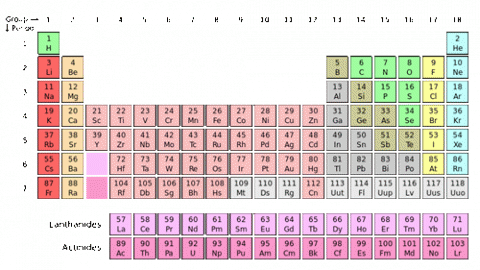
Jestliže seřadíme chemické prvky podle vzrůstající atomové hmotnosti (podle dnešních zvyklostí podle vzrůstajícího protonového čísla), pak zjistíme, že jejich chemické a fyzikální vlastnosti se pravidelně opakují. Tohoto periodického zákona si všiml v roce 1869 Dmitrij Ivanovič Mendělejev a poprvé zformuloval periodickou soustavu prvků, do které uspořádal tehdy 60 známých prvků. V tabulce mu vznikly mezery pro do té doby neobjevené prvky. Ještě za jeho života byla tabulka doplněna o předpovězené prvky gallium a germanium. Dnešní periodická tabulka je již kompletní pro přirozeně se vyskytující prvky s protonovým číslem do 92. Prvky s větším protonovým číslem se vyrábí uměle a nazývají se transurany. Proto není počet prvků v periodické tabulce konečný. Aktuálně se počet pohybuje do 120 prvků.
Prvky jsou v periodické tabulce seřazeny do řádků a sloupců. Řádky se nazývají periody. V jednom sloupci mají prvky shodný počet elektronů ve valenční vrstvě (nejvyšší elektronová hladina, která je zaplněna elektrony). Právě valenční elektrony se účastní chemických vazeb a určují chemické vlastnosti prvku. Proto také mají prvky v jednom sloupci podobné chemické vlastnosti.
Atomová slupka nebo podslupka, která je zcela zaplněna elektrony se nazývá uzavřená. Uzavřená podslupka s obsahuje dva elektrony, uzavřená podslupka p šest elektronů, uzavřená podslupka d deset elektronů atd. Atomy s uzavřenými slupkami jsou velmi stabilní, chemicky pasivní. Atomy s jedním elektronem ve vnější slupce tento elektron často ztrácejí. Atomy, kterým ve vnějších slupkách jeden elektron chybí, se ho snaží získat. Pořadí, v němž se elektronové podslupky v atomech zaplňují, je 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d. Na základě elektronových konfigurací lze odůvodnit chemické a fyzikální vlastnosti prvků.
Periodická tabulka je rozdělena do sedmi period a 18 skupin. Dále je tabulka rozdělena do 4 bloků, podle toho, ve kterém orbitalu se nacházejí valenční elektrony. Blok s objsahuje prvky 1. a 2. skupiny, blok p prvky 13. až 18. skupiny, blok d prvky 3. až 12. skupiny a blok f je vyčleněn pod tabulkou a obsahuje 28 prvků rozdělených do dvou skupin – lanthanoidy a aktinoidy.
Kdykoli je to možné, zůstávají elektrony v atomu nespárované, tj. mají rovnoběžné spiny. Toto pravidlo se nazývá Hundovo pravidlo a můžeme je přepsat takto: podslupky se stejnou energií (mají stejné kvantové číslo hlavní a vedlejší) se zaplňují nejdříve jedním elektronem se stejným spinem, potom vznikají elektronové páry. Pomocí tohoto pravidla můžeme vysvětlit feromagnetismus železa, kobaltu a niklu. Jejich podslupky 3d jsou jen částečně zaplněny a elektrony v těchto podslupkách se nesdružují do dvojic s opačnými spiny a nedovolují tak vzájemné zrušení spinových magnetických momentů. Každý atom má pak velký výsledný magnetický moment.
U více elektronových atomů dochází k emisi záření jen při přechodech mezi některými podslupkami. Výběrové pravidlo říká, že povolené přechody jsou pro Δl = ±1 a Δm = 0, ±1. Ostatní přechody jsou zakázané a k emisy elektromagnetických vln nedojde. Na vzniku atomových spekter se podílejí valenční elektrony, tj. elektrony v neuzavřené slupce.