S koncepcí kinetické teorie látek přišel Rudolf Clausius v roce 1857 v článku Über die Art der Bewegung welche wir Warme nennen (O povaze pohybu, který nazýváme teplem). Základem kinetické teorie látek jsou tři experimentálně ověřené poznatky. Látky kteréhokoliv skupenství se skládají z částic. Částicemi budeme nazývat atomy, molekuly nebo ionty. Jednotlivé částice nemůžeme pozorovat okem, lupou ani mikroskopem. Používají se moderní zobrazovací techniky, např. elektronový mikroskop nebo rastrovací tunelový mikroskop. Na základě měření bylo zjištěno, že rozměry částic jsou řádově 10–10 m = 0,1 nm. V jednom m3 vzduchu je za normálního tlaku asi 30 · 1015 molekul. Objemy těchto částic i jejich vzájemné vzdálenosti v různých látkách jsou odlišné. V atmosféře při povrchu Země je ve vzduchu 99 % prostoru bez molekul a jen 1 % zaujímají molekuly plynů, ze kterých je vzduch složen.
Částice se v látkách neustále neuspořádaně pohybují, mohou vykonávat pohyb posuvný (např. v plynu), otáčivý (např. víceatomové molekuly plynu) a kmitavý pohyb (např. v pevných látkách nebo kapalinách). U tělesa, které je v klidu, nepřevládá v daném okamžiku žádný směr, ve kterém by se pohybovala většina částic. Neustálý a neuspořádaný pohyb částic v látkách se nazývá tepelný pohyb. Důkazy o tepelném pohybu mohou podat jevy jako difuze, tlak plynu nebo Brownův pohyb. Tlak plynu je vyvolaný nárazy molekul dopadajících na stěny nádoby s plynem. Při vyšší teplotě se molekuly pohybují rychleji, a proto tlak plynu roste s teplotou.
Částice na sebe navzájem působí silami. Tyto síly jsou při malých vzdálenostech odpudivé, při větších vzdálenostech přitažlivé. Částice jsou složité objekty mikrosvěta, nelze proto mezi nimi změřit velikosti sil. Proto si musíme situaci dost zjednodušit. Zaměříme se jen na vzájemné působení mezi dvěma částicemi, jejichž kladně nabitá jádra jsou obklopena záporně nabitými elektrony. Při vzájemném přibližování obou částic působí mezi sebou elektronové obaly a kladně nabitá jádra obou částic. Z teoretických úvah a složitých výpočtů plyne, že výsledkem vzájemného působení je vznik přitažlivé a odpudivé elektrické síly. To odpovídá naší zkušenosti: při stlačování tělesa, kdy částice k sobě více přibližujeme, vnímáme odporovou sílu bránící dalšímu stlačování tělesa, naopak při prodlužování vnímáme sílu, která tělesa stlačuje. Grafické znázornění závislosti velikosti síly, která působí mezi dvěma částicemi, na jejich vzdálenosti
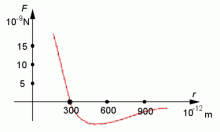
Závislost síly působící mezi částicemi na vzdálenosti částic.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Z grafu plyne: při určité vzdálenosti r0 je síla, kterou na sebe částice působí, nulová. (např. pro vodu je tato vzdálenost 0,3 nm). Ve vzdálenosti větší než r0 je síla působící mezi částicemi přitažlivá. Ve vzdálenosti menší než r0 je síla mezi částicemi odpudivá.
Z existence vzájemného působení mezi částicemi také vyplývá, že soustava částic má vnitřní potenciální energii. Pro rovnovážnou polohu částic se tato energie nazývá vazebná energie. Je to práce, kterou je nutno vykonat, aby došlo k rozrušení vazby mezi částicemi.
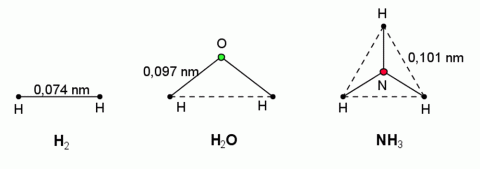
Vazby mezi částicemi v jednotlivým molekulách.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Vazebná energie určuje strukturu molekul, vzájemnou polohu částic. Dvouatomové molekuly jsou lineární, tříatomové molekuly mohou existovat buď jako lineární (např. CO2), nebo častěji jako rovinné – trojúhelníkové (např. H2O). Víceatomové molekuly jsou nejčastěji prostorové (např. NH3 má tvar trojbokého jehlanu) nebo rovinné (např. molekula benzenu C6H6). Molekuly celé řady organických sloučenin obsahují stovky, tisíce až statisíce atomů uspořádaných do složitých prostorových útvarů. Znalost struktury molekul je důležitá nejen ve fyzice a chemii, ale i pro biologii, medicínu, zemědělství a další obory.
Vzájemná přitažlivost molekul dvou různých látek způsobuje, že se jedna látka udrží rozptýlená v druhé. Vznikají tak směsi kapalin, roztoky, emulse (dvě smíchané kapaliny), pěna (plyn v kapalině), mlha (kapalina v plynu) nebo dým (pevné částečky v plynu).

