O objevu galvanického článku jsme již psali. Teď si povíme jak vlastně galvanický článek funguje. Naplníme–li nádobu vodným roztokem kyseliny sírové H2SO4, pak budou její molekuly disociovány na ionty 2H+ a SO4--.
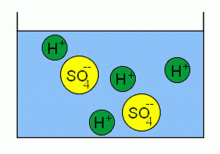
Disociace kyseliny sírové na ionty.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Jestliže do zředěné kyseliny sírové vložíme zinkovou elektrodu, začne se postupně zinek rozpouštět. Kov obsahuje neutrální atomy, kladné ionty a volné elektrony. Kladné ionty působí tlakem na styčnou plochu kovu a elektrolytu a tlačí ionty Zn++ do elektrolytu. V elektrodě přebývá záporný náboj a v elektrolytu kladný náboj. Zároveň přitažlivé síly mezi kladnými ionty elektrolytu a zápornými ionty kovu brání trvalému přechodu iontů do roztoku. K vyrovnání nábojů mezi elektrodami tak nemůže dojít.
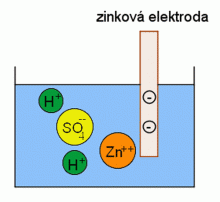
Kyslina sírová a zinková elektroda.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Mezi elektrodou a elektrolytem vznikne rozdíl potenciálů a proto i elektrické napětí. Ponoříme–li do roztoku měděnou elektrodu, dojde ke stejnému jevu. Mezi elektrodou a elektrolytem vznikne elektrické napětí. Zinková elektroda se ale bude rozpouštět rychleji, proto na ní bude víc elektronů. Potenciál obou elektrod bude tedy různý a vznikne mezi nimi elektrické napětí, které se nazývá elektromotorické napětí. Napětí vznikne i mezi volnými konci obou elektrod – naměříme tzv. svorkové napětí. Přebytek volných elektronů ze zinkové elektrody se bude pohybovat směrem k měděné elektrodě – obvodem bude protékat elektrický proud.
První stálý článek sestavil v roce 1836 Daniell. Zinek ponořil do slabé kyseliny sírové, měď do roztoku skalice modré. Oba roztoky oddělil měchýřem. Později na radu londýnského kupce Gassiota použil místo měchýře pórovitou nádobu. Roku 1828 zavedl William Sturgeon ochranné amalgamování zinku, roku 1839 nahradil Grove měď platinou v kyselině dusičné, Robert Bunsen doporučil přidat ke kyselině sírové dvojchroman draselný. Z roku 1868 pochází článek od Georgese Leclanchéa. O dvacet let je mladší suchý článek, který vytvořil Gassner. Přehled dalších galvanických článků, které se liší materiálem elektrod nebo elektrolytem, je v následující tabulce.
|
Článek |
Voltův |
Leclanchéův |
Bunsenův |
Rtuťový |
Lithiový |
|---|---|---|---|---|---|
|
záporná elektroda |
zinek |
zinek |
zinek |
zinek |
uhlík |
|
kladná elektroda |
měď |
uhlík |
uhlík |
rtuť |
lithium |
|
elektrolyt |
kyselina sírová |
salmiak |
kyselina sírová |
HgO |
SOCl2 |
|
depolarizátor |
– |
burel, tuha |
kyselina dusičná |
– |
– |
|
vnitřní napětí |
1,0 V |
1,5 V |
1,9 V |
1,4 V |
3,5 V |
Suchý článek nedokáže dodávat napětí po nekonečnou dobu. Po čase se napětí mezi elektrodami sníží. Příčinou je polarizace elektrod. Současně s vybíjením článku probíhá na anodě elektrolýza, díky níž se anoda pokrývá vyloučenou látkou. To má za následek zmenšení kladného potenciálu anody a snížení napětí zdroje. Aby takový článek pracoval trvale, je třeba průběžně odstraňovat z kladné elektrody vznikající látku, čili depolarizovat článek. K tomu se požívají chemické látky (u suchého článku je to MnO2), s nimiž daná látka reaguje.
Alkalické články (zásadité, oproti akumulátorům, které jsou kyselé) mají delší životnost a lze z nich získat více elektrické energie. Záporná elektroda lisovaná z práškového zinku je obklopena kladnou elektrodou, kterou tvoří směs burelu a grafitu. Elektrolytem je hydroxid draselný KOH rozpuštěný v gelu. Celý článek je chráněn ocelovým pláštěm, který zabraňuje proniknutí chemických látek článku do okolí.
Problémem chemických zdrojů napětí se zabýval i Charles Wheatstone, Gustav Robert Kirchhoff nebo Werner Siemens. Vyhovující řešení předložil teprve Gaston Planté v roce 1860. Za elektrody si zvolil olověné desky a za elektrolyt roztok kyseliny sírové a vody. Sestrojil tak první olověný akumulátor (z lat. accumulator – hromaditel). Tento první akumulátor se musel pořád nabíjet a vybíjet, aby chemické reakce probíhaly hlouběji a hlouběji v olověných elektrodách. Tento nedostatek odstranil Camille Faure, který zhotovil olověné desky ve tvaru mřížoví.
Akumulátor se stává zdrojem napětí teprve po nabití. Po zapnutí elektrického proudu se elektrolyt složený z roztoku kyseliny sírové H2SO4 a vody H2O rozkládá, na anodě se vylučuje vodík, současně se katoda pokrývá čistým pórovitým olovem a anoda načervenalým kysličníkem olovičitým PbO2.
anoda: PbSO4 + 2H2O ↔ PbO2 + 3H+ + HSO4–
katoda: PbSO4 + H+ + 2e– ↔ Pb + HSO4–
Vodík, který obalil anodu, způsobil, že po dobu připojení ke zdroji napětí nejsou v elektrolytu dvě elektrody ze stejného kovu, ale z materiálů různých. Mají mezi sebou elektromotorické napětí. Po odpojení elektrod od zdroje proudu – po nabití, se akumulátor stává zdrojem elektrického proudu jako galvanický článek. Vzniklý článek má po nabití napětí asi 2,1 V. Při provozu probíhá v akumulátoru opačný děj, jehož výsledkem je vznik síranu olovnatého PbSO4 na obou elektrodách a vody.
Postupné snižování napětí akumulátoru může jít až na hodnotu 1,85 V. Pak je třeba akumulátor znovu nabít. Pokud by napětí kleslo pod 1,85 V, došlo by k nevratnému sulfatizačnímu procesu a akumulátor by nebylo možné znovu nabít. Poněvadž kyselina sírová při vybíjení akumulátoru reaguje s elektrodami za vzniku vody, snižuje se současně hustota elektrolytu. Měřením hustoty elektrolytu areometrem lze orientačně zjistit, do jaké míry je akumulátor vybit. Během provozu se z akumulátoru odpařuje voda, proto je nutné ji přilévat. Účinnost olověného akumulátoru je asi 75 – 80 %. Kapacita kondenzátoru se udává v ampérhodinách (Ah).
Nedostatkem olověných akumulátorů je jejich váha a citlivost. Proto byly vyvíjeny nové druhy akumulátorů. S novinkou přišli Thomas Edison a Jungner, kteří sestavili akumulátor, jehož katodou je deska železná a anodou deska niklová, elektrolytem roztok louhu draselného ve vodě. Při stejné váze jako předchozí akumulátor má větší kapacitu.
|
Akumulátor |
Olověný |
Alkalický Ni–Fe |
Alkalický Ni–Cd |
Stříbrozinkový |
|---|---|---|---|---|
|
záporná elektroda |
Olovo |
železo |
kadmium |
zinek |
|
kladná elektroda |
PbO2 |
nikl |
Ni(OH)2 |
Ag2O2 |
|
elektrolyt |
H2SO4 + H2O |
KOH hydroxid draselný |
KOH |
Ag2O2 |
|
vnitřní napětí |
2,0 – 2,7 V |
1,4 V |
1,2 – 1,4 V |
1,5 V |
Elektrolýzu využívá i palivový článek, který se skládá ze dvou elektrod z pórovitého materiálu, mezi nimž je elektrolyt. K vnějším stěnám elektrod je pod tlakem přiváděn plynný vodík a kyslík. V pórech kyslíkové elektrody vznikají reakcí kyslíku a vody aniony OH-, které přecházejí do elektrolytu. V pórech vodíkové elektrody se ionizují molekuly vodíku na kationy H+, které přecházejí do elektrolytu a reagují s OH- za vzniku vody. Na vodíkové elektrodě přebývá jeden záporný elektron. Jestliže obě elektrody vodivě spojíme, získáme zdroj elektrické proudu. Výhodou palivového článku je, že se nevybíjí podobně jako galvanický článek nebo akumulátor, má až 80 % účinnost.
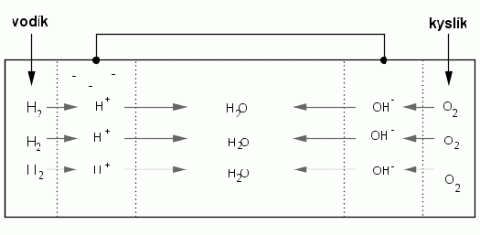
Princip palivového článku.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Zajímavé chemické zdroje napětí najdeme i v přírodě, počet živočišných druhů schopných vytvořit elektrické napětí dosahuje nejméně 5000, většinou to jsou ryby a paryby. Zdroj elektrického napětí je speciální tkáň vyvinutá z příčně pruhované svaloviny. Zpravidla kopíruje páteř. Velikost elektrického výboje je závislá většinou na věku zvířete (čím starší, tím větší výboj). Živočichové využívají elektrický výboj nejen k obraně nebo omráčení kořisti, ale také k orientaci a komunikaci. Parejnok elektrický (torpedo marmorata) loví potravu pomocí elektrického orgánu, kterým kořist omráčí. Orgán je složen ze svalových vláken, která jsou přeměněna v elektrické články zvané elektroplaxy. Napětí samostatného článku je nepatrné, avšak po sečtení všech článků dosahuje výboj napětí až 300 V a intenzity proudu 7 až 8 A. Pro člověka není smrtelně nebezpečný, většinou způsobí jen momentální šok bez dalších následků. Už ve starověku byl znám z povodí jihoamerické řeky Orinoko ještě úhoř elektrický (electrophorus electricus) dlouhý kolem 2,5 m, ohrožující své okolí napětím až 600 V, africký sumec elektrický (clarius gariepinus), který žije v Nilu a produkuje napětí až 200 V. Elektrických šoků, způsobených touto rybou, údajně používali tehdejší lékaři k léčbě nervových onemocnění. Serinonius Largus používal rejnoka k léčení podagry a bolestí hlavy císaře Claudia.

Parejnok elektrický.
Zdroj: commons.wikimedia.org. Autor: Philippe Guillaume. Under Creative Commons.Ptakopysk je velmi zajímavé australské zvíře s kachním zobákem. Loví v noci a ve vodě, a proto mu je čich a zrak k ničemu. Vyvinul si proto jedinečný nástroj – zobák. Ten je pokrytý 40 000 receptory, které dokáží zachytit nejjemnější bioelektrické pole generované svalovými impulzy jeho kořisti.
V současnosti patří k nejpoužívanějším lithium-iontové baterie. Vyznačují se velmi dobrým poměrem mezi hustotou energie a objemem. Poprvé spatřil tento druh baterií světlo světa v polovině 60. let 20. století v Bellových laboratořích. Nejprve byla použita kladná elektroda vyrobená ze sulfidu kovů a záporná elektroda z kovového lithia. Tato kombinace ale vykazovala řadu špatných vlastností, proto postupně došlo k výměně materiálu elektrod. V roce 1990 firma SONY představila novou technologii. Pro zápornou elektrodu použili směs uhlíku obohacenou o lithium a polyolefin. Těmto bateriím začal ředitel SONY K. Tozawa říkat Li-Ion. Označení Ion je kvůli kladným iontům lithia, které putují během nabíjení z kladné elektrody na zápornou. Při vybíjení je postup opačný. Poprvé se nový typ baterie objevil v roce 1991 u mobilního telefonu SONY Handyphone HP-211. Běžně se dnes používají jako materiály kladných elektrod LiCoO2, LixMn2O4, LiNiO2 a LiV2O5. Jako elektrolyt se nejčastěji používá lithium hexafluorofosfát LiPF rozpuštěný v nepolárním rozpouštědle.
S prototypem nové generace lithium-iontových baterií s označním SCIB přišla firma Toshiba. Nový druh baterie dokáže po 5000 nabíjecích cyklech uchovat až 90 % kapacity. Baterie je tvořena lithiovou anodou a katodou tvořenou oxidy titanu a niobu. Další skvělou vlastností je rychlost nabíjení, která se pohybuje v řádu několika minut. Na trh by se měla nová baterie dostat v roce 2019.