Elektrolýza nalezla značné využití ve výrobě. V roce 1854 zavedl v Anglii Robert Bunsen průmyslovou výrobu čistých kovů z přírodních rud (elektrometalurgie), které se v přírodě vyskytují převážně v podobě sloučenin, např. oxidů. Příkladem je hliníková ruda bauxit, v podstatě oxid hlinitý. Elektrolýza roztavené směsi rudy s potřebnými přísadami se provádí v uhlíkové vaně, která je katodou. Anodu tvoří uhlíkové elektrody ve tvaru tyčí. Roztavený hliník, který při elektrolýze vzniká, se hromadí u dna vany a odtud se vypouští. Nevýhodou této technologie je však velká spotřeba elektrické energie. Podobně se vyrábí např. hořčík, sodík, vápník.
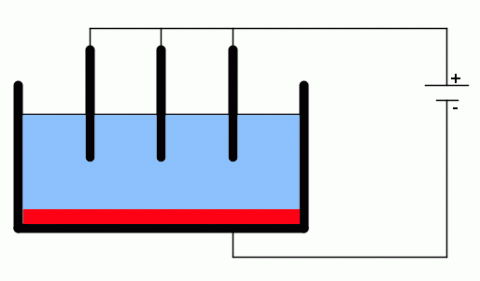
Princip elektrometalurgie.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Elektrolytické čištění kovů umožňuje odstranit z kovu nežádoucí příměsi. Např. pro elektrotechnické účely je potřebná dostatečně čistá měď, poněvadž její odpor je podstatně nižší než odpor surové mědi vyráběné v hutích. Z mědi určené k elektrolytickému čištění se zhotovují tlusté desky, které se vloží do elektrolytické vany jako anody, tj. kladné elektrody. Katodou je tenká deska z čisté mědi a jako elektrolyt se používá vodný roztok síranu měďnatého. Elektrolýza probíhá při určitém napětí, při němž se na katodě vylučuje čistá měď a ostatní příměsi klesají ke dnu jako kal. Podobným způsobem se získávají i jiné kovy, např. nikl, zinek.
Galvanické pokovování nebo–li galvanostegie je důležitý technologický postup, při němž se výrobky z méně ušlechtilých kovů pokrývají vrstvou ušlechtilejšího kovu, např. chrómu, který je odolnější proti korozi. To má značný význam pro snížení škod, které nežádoucí korozí kovových materiálů vznikají. Průkopnické práce v oblasti galvanostegie položil Werner Siemens a Moritz Jacobi, který také vypracoval metodu ke zhotovování velmi přesných otisků mincí, uměleckých předmětů apod. pomocí elektrického proudu, tzv. galvanoplastiku. Stejným problémem se ve stejnou dobu zabývalo několik dalších vědců. Pomocí galvanoplastiky se vyrábí např. gramofonové desky.
Polarografie patří mezi elektrochemické analytické metody. Slouží k určování přítomnosti a koncentrace neznámých látek v roztoku. Tuto metodu vytvořil český fyzikální chemik Jaroslav Heyrovský a v roce 1959 za objev polarografie obdržel jako první Čech Nobelovu cenu za fyziku. Princip spočívá ve vyhodnocování závislosti elektrického proudu na napětí na dvojici elektrod, které jsou ponořené do roztoku, v němž probíhá elektrolýza. Závislosti mají tvar vln, jejichž poloha charakterizuje jednotlivé druhy látek. Z velikosti nárůstu proudu lze určit koncentraci příslušné látky. Katodou je odkapávající rtuť čímž je zaručeno, že se povrch elektrody neustále obnovuje.

Nejstarší typy polarografů.
Zdroj: KORYTA, J. Jaroslav Heyrovský. Praha: Melantrich, 1990. ISBN 32-026-90.
Povrch kovů se může porušit nejen mechanicky, ale i chemicky nebo elektrochemicky. Tento jev nazýváme koroze – jeho nejčastějším typem je oxidace působením vzdušného kyslíku a vlhkosti vzduchu. Kovové součástky se při styku s vodou stávají miniaturními galvanickými mikročlánky, které způsobují elektrolýzu. Kov tvořící anodu se vlivem této elektrolýzy znehodnocuje. Koroze představuje závažný ekonomický problém, odhadovaná roční ztráta kovů korozí tvoří asi polovinu světové produkce. Metod omezujících korozi, je celá řada, např. u kovů, které jsou v trvalém styku s vodou, se používá katodová ochrana; voda v parních kotlích se zbavuje iontů průchodem kovovými pilinami; povrch kovu se chrání přísadami zmenšujícími napětí mikročlánků; poměrně jednoduchou a účinnou ochranou jsou povrchové nátěry; pozinkování ocelových součástí (např. okapy, drátěné pletivo), protože zinek koroduje asi 10krát pomaleji než ocel.
Vylučování vodíku při elektrolýze vody představuje perspektivní možnost alternativního a ekologicky čistého zdroje energie. Ve speciálním zařízení probíhá elektrolytický rozklad vody na vodík a kyslík. Vodík se shromažďuje a používá jako palivo, při jehož hoření nevznikají žádné nežádoucí produkty.
Elektrolýza, tedy přemisťování iontů v kapalině pomocí stejnosměrného elektrického proudu, se využívá i v medicíně. Při průchodu stejnosměrného elektrického proudu tkání dochází ke změně koncentrace jednotlivých iontů v tkáni, k elektrolytickému rozkladu a změně pH. Chemickými změnami v tkáních jsou drážděna nervová zakončení, organismus proto vnímá průchod elektrického proudu jako různý stupeň bolesti, v závislosti na velikosti proudu. Elektrochemické změny vyvolané stejnosměrným proudem působí především na svaly tím, že dojde k jejich stažení, které je ale patrné jen při zapnutí/vypnutí nebo změně velikosti proudu. Jednou z léčebných metod je galvanizace, která využívá elektrolytických účinků stejnosměrného proudu. Vlivem chemických změn dochází ke změně pH. Pod zápornou elektrodou pH roste a zvyšuje se zde dráždivost. Toho se využívá k léčení ochrnutí a snížené citlivosti. U kladné elektrody se pH snižuje, což se využívá k tlumení bolesti. Kromě změny pH dochází pod elektrodami také k zvýšení prokrvení. Především v očním lékařství se používá metoda iontoforéza, která spočívá v přenosu léků s elektrickým nábojem přímo do organismu. Takto se aplikují třeba kationty draslíku, vápníku, mědi, zinku, včelího jedu, histaminu nebo anionty chloru, bromu, jodu, vitaminu C, penicilinu atd. Výhodou této aplikace je bezbolestnost.
