Roku 1789 pozorovali holandští fyzikové van Troostwijk a Deimann zajímavý jev. Když ponořili do okyselené vody dva kovové dráty, z nichž jeden byl spojen s kladným pólem sady elektrických článků a druhý s pólem záporným, začaly z vody unikat bublinky plynu na těch místech, kde byly do ní dráty ponořené. Oba fyzikové zjistili, že jde o dva různé plyny, z nichž jeden je dýchatelný a druhý hořlavý. O jedenáct let později, tedy v roce 1800, byl objeven chemický účinek elektrického proudu. Pokusy s galvanickým článkem a s elektrickým obvodem konal chirurg westminsterské nemocnice sir Anthony Carlisle a vodárenský inženýr William Nicholson. Experimentátoři vodivost obvodu vylepšili troškou slané vody. Při průchodu elektrického proudu se objevily bublinky plynů. To ukazovalo na chemické působení elektrického proudu. Touto problematikou se zabýval i Humphrey Davy, který zjistil, že soli rozpuštěné ve vodě nebo ve formě taveniny je také možné pomocí elektrolýzy chemicky rozložit. Tímto zobecněním byl položen základ metody zvané elektrolýza (z řeckého lýsis – roztok).
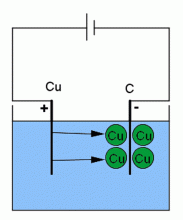
K vysvětlení elektrolýzy použijeme příkladu s vodným roztokem skalice modré (síranu měďnatého CuSO4), do kterého umístíme měděnou a uhlíkovou elektrodu. Molekuly modré skalice se díky elektrolytické disociaci rozloží na ionty Cu++ a SO4---. Připojíme zdroj stejnosměrného elektrického napětí tak, že měděná elektroda je anoda a uhlíková elektroda katoda.
Necháme roztokem procházet elektrický proud a po ukončení pokusu zjistíme, že se uhlíková elektroda pokryla vrstvičkou mědi s charakteristickým načervenalým zbarvením a SO4-- reagoval s anodou tak, že jí předal svůj náboj a reagoval za vzniku molekuly CuSO4. Elektrolýzu můžeme chemicky popsat
![]()
Dostatečně přesným vážením bychom prokázali, že se hmotnost měděné elektrody zmenšila. V elektrolytu se počet molekul modré skalice ani počet molekul vody nemění.
Zaměníme–li obě elektrody, tj. anoda je uhlíková, katoda je měděná, pak ionty SO4-- nebudou chemicky reagovat s materiálem elektrody, ale budou reagovat s molekulami vody v okolí anody
![]()
U anody vzniká kyselina sírová a plynný kyslík, na katodě se vylučuje měď z roztoku skalice modré. V elektrolytu ubývá mědi a přibývá molekul kyseliny sírové.
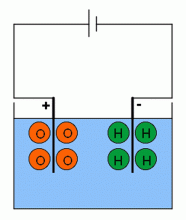
Druhým příkladem je rozklad vody, kde elektrody jsou z platiny. Po připojení zdroje napětí pozorujeme, že se na elektrodách uvolňují plyny v podobě bublinek. Na anodě je to kyslík a na katodě vodík. Když tento děj necháme chvíli probíhat, zjistíme, že vodík má dvojnásobný objem než kyslík.
Při průchodu elektrického proudu elektrolytem se pohybují kladné ionty ke katodě a záporné ionty k anodě. Dotykem s elektrodami se neutralizují, tj. předávají elektrodám svůj náboj a stanou se neutrálními. Přitom se buď vyloučí na elektrodách, nebo dojde k jejich chemické reakci s materiálem elektrod, případně k reakci s elektrolytem. Na katodě se nejčastěji vylučují kovy, které pokrývají povrch elektrody, popř. i reagují s elektrolytem v okolí elektrody. Na katodě se rovněž vylučuje vodík, který v podobě bublinek z elektrolytu uniká. Plyn je také obvyklým výsledkem reakce na anodě.
Zkoumání elektrolýzy dalo vzniknout novému oboru – elektrochemii. Pomocí elektrolýzy objevil Humprey Davy dva nové prvky – sodík a draslík. Elektrolýzou se zabýval v první polovině 19. století anglický fyzik a Davyho asistent Michael Faraday, který zformuloval Faradayův zákon pro elektrolýzu: pro hmotnost m látky vyloučené při elektrolýze platí
![]()
Veličin A je elektrochemický ekvivalent, který závisí na chemickém složení látky. Druhý zákon říká, že množství iontů, které vyloučí tentýž proud ze dvou různých elektrolytů, jsou vždy ve zcela určitém poměru, který vyplývá z jejich chemických ekvivalentů. Pomocí prvního zákona můžeme měřit velikost protékajícího proudu převedením na měření hmotnosti vyloučené látky, v tzv. coulometrech (nebo také coulombmetrech nebo voltametrech), které mají dnes jen historický význam.