V roce 1898 Ernest Rutherford objevil v radioaktivním záření dvě složky, které se lišily svou pronikavostí. Tu méně pronikavou nazval α a tu více pronikavou β. Brzy poznal, že by radioaktivní záření mohlo být klíčem k rozřešení záhady atomové struktury. Na základě návrhu Ernesta Rutherforda provedli Hans Geiger a Ernest Marsden v roce 1911 experiment, při kterém ostřelovali částicemi alfa zlatou fólii a jiné materiály různé tloušťky. Umístili kousek radioaktivní látky do olověné skříňky, v níž byl otvor. Záření alfa olovem nepronikne, ale tenký proud záření vyjde otvorem a na své cestě narazí na tenoučkou zlatou fólii. Za ní bylo umístěno pohyblivé stínítko pokryté sulfidem zinečnatým, díky němuž byl dopad částice alfa doprovázen viditelným světelným zábleskem.
Podle Thomsonova modelu se očekávalo, že většina částic alfa projde fólií beze změny a jen malé množství jich bude vykazovat nepatrné odchylky. Ve skutečnosti Geiger a Marsden zjistili, že z každých přibližně deseti tisíc α částic se jedna odchyluje o úhel větší než 90° a dokonce bylo registrováno i několik jednotlivých α částic rozptýlených pod úhlem blížícím se 180° (zpětný odraz). I když tento velkoúhlový odraz pozorovali jen zřídka, přesto by podle Thomsonova modelu k němu nemělo dojít nikdy.
Od pokusů Thomsona bylo také známo, že kladně nabitá hmota v atomu musela být asi 1800 krát těžší než elektrony v něm vázané. Na základě tohoto modelu atomu a za použití Newtonových pohybových rovnic bylo možné spočítat tvar úhlového rozdělení rozptýlených elektronů. Předpovězené rozdělení při rostoucím úhlu rozptylu strmě klesalo s tím, že počet případů rozptylu na velké úhly byl zanedbatelný.
Rozdělení, které Rutherford, Geiger a Marsden naměřili, bylo ovšem s tímto očekáváním v hrubém rozporu a částic rozptýlených na velké úhly bylo daleko víc, než předpovídal Thomsonův model. Podrobná analýza dat ukázala, že naměřené rozdělení odpovídá tomu, že veškerá kladně nabitá hmota atomu je soustředěna ve velmi malém objemu, zhruba odpovídajícímu kouli o poloměru 30 femtometrů. To je asi tisíckrát menší vzdálenost, než je poloměr atomu zlata. Z toho Rutherford usoudil, že Thomsonův model neplatí, že atomy jsou snadno prostupné a že kladný náboj i hmota atomů jsou soustředěny do velmi malého prostoru uprostřed atomu. Tuto část se nazval jádro atomu.
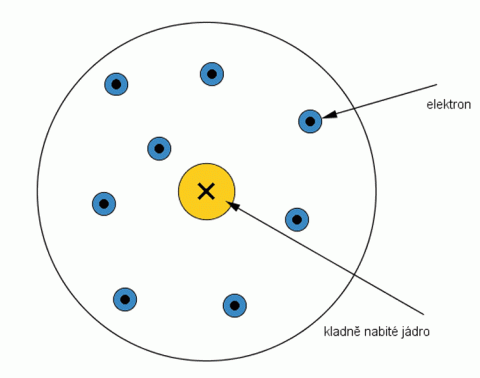
Rutherfordův model atomu.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Rutherford předpokládal, že atom zlata má náboj qAu = 79e, qα = 2e. Dále předpokládejme, že jádro atomu zlata má tvar kladně nabité koule o poloměru R. Mezi částicí α a jádrem atomu zlata působí odpudivá síla, která narůstá podle Coulombova zákona, přičemž maximální je na povrchu koule. Aby mohlo dojít k odrazu zpět, musí α částice mířit přesně na střed koule. V místě, kde dojde k zabrždění α částice vlivem odpudivé síly, je potenciální energie α částice rovna její počáteční kinetické energii
![]()
Díky tomu, že můžem odhadnou energii α částice na počátku experimentu na Ek = 7,7 MeV, můžeme z předchozí rovnice vyjádřit poloměr jádra
![]()
Po dosazení všech hodnot získáme poloměr atomového jádra asi 10–14 m, při použití nižší energie až 10–15 m, zatímco atom má poloměr asi 10–10 m.
Na základě experimentů a výpočtů vyslovil Rutherford následující představu o stavbě atomu: Každý atom se skládá z jádra, v němž je soustředěna takřka veškerá hmota atomu (přibližně 99,95 % hmotnosti atomu). Na základě této představy o stavbě atomu Rutherford vypočítal, jaká část svazku α částic dopadajícího na tenkou zlatou fólii by měla být rozptýlena do daného úhlu. V roce 1920 jeho žák James Chadwick jeho teoretické předpovědi experimentálně potvrdil.
Model atomu, který Rutherford vytvořil se nazývá jaderný, resp. Rutherfordův model atomu. Jím formulovaná představa není totožná s tzv. planetárním modelem atomu, který vznikl v souvilosti se snahou vysvětlit stabilitu atomu a popsat jej i z dynamického hlediska. Tato představa vznikla krátce po objevu elektronu, již v roce 1901 se o ní zmínil Jean Perrin nebo Henri Poincaré. Wilhelm Wien v roce 1905 vystoupil na sjezdu německých přírodovědců a lékařů s kritikou této představy pro problémy s objasněním čárových atomových spekter. Podle klasické fyziky by měl elektron, obíhající kolem jádra, vlivem dostředivého zrychlení po určité době vyzářit veškerou svoji energii v podobě spojitého spektra elektromagnetického vlnění. Jeho „trajektorie“ by tak měla charakter spirály. Tomu neodpovídaly poznatky o čárovém charakteru spekter a stabilitě atomu.

