Zjištění, že elektrony lze uvolnit z povrchu kovu zářením – fotoelektrický jev, svědčilo ve prospěch myšlenky, že všechny látky obsahují elektrony. Protože se atomy jeví navenek neutrální, bylo nutné ho kompenzovat stejně velkým kladným nábojem.
Na podzim roku 1903 předložil Philipp Lenard hypotézu, že se atomy různých prvků skládají z různého počtu stejných komponent, jež nazval dynamidami. Tyto dynamidy, které si představoval jako těsné, elektricky neutrální spojení elektronu s mnohem hmotnějším kladně nabitým objektem, měly být rozloženy rovnoměrně v celém objemu atomu. Lenardův dynamidový model atomu se velmi liší od později skutečně zjištěné struktury atomu, přesto byl Lenard prvním, kdo vyslovil správný názor, že atomy nejsou neproniknutelné, ale skládají se z malých objektů, mezi nimiž je prázdný prostor.
Ve své době nejpropracovanějším model byl model z roku 1903 od Josepha Johna Thomsona. Podle něj je hmotnost atomu a s ní i celý kladný náboj, rozdělený spojitě a přibližně rovnoměrně po celém objemu atomu. V této, tak trochu záhadné látce, se vznášejí malé a lehké elektrony, které jsou držené v atomu přitažlivými silami od kladného náboje podobně jako rozinky v anglickém pudinku. Proto se tento model nazývá pudinkový. Podle tohoto modelu je atom v mechanické a elektrické rovnováze. Nastane–li vnějším působením porucha v uspořádání elektronů, kmitají kolem rovnovážných poloh a vysílají elektromagnetické záření. Elektrony byly podle Thomsona rozloženy do vrstev, v každé vrstvě bylo nejvýše 5 elektronů. Za atomem, který měl jeden elektron následoval další, který měl elektrony dva, další tři, čtyři a pět, další atom už měl první vrstvu plnou, a tak plnil vrstvy nové stejným způsobem. V roce 1869 Dmitrij Ivanovič Mendělejev publikoval tabulku prvků. Thomson první přišel s myšlenkou, že by pravidelně se opakující vlastnosti prvků mohly souviset s jejich atomovou strukturou, především s počtem elektronů.
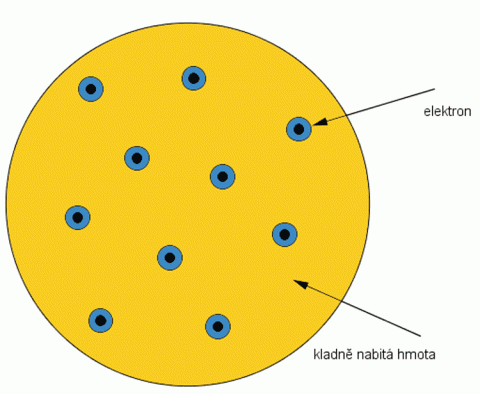
Thomsonův model atomu.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Na základě svého modelu se Thomson pokusil vysvětlit některé jevy. Ionizaci vysvětlil jako emisi elektronu z atomu dodáním energie. Na základě představy, že elektrony v atomu kmitají s určitými frekvencemi kolem rovnovážných poloh a tím budí elektromagnetickou vlnu téže frekvence, dokázal vysvětlit spektrum záření emitovaného atomem. Na druhou stranu měl Thomsonův model řadu nedostatků. Výpočty na základě Thomsonova modelu atomu vodíku ukázaly, že frekvence kmitů elektronů nemají žádnou souvislost s frekvencemi pozorovaných spektrálních čar.

