Jestliže nalijeme kapalinu do uzavřené nádoby, je počet molekul opouštějících povrch kapaliny větší než počet molekul, které se za stejnou dobu vracejí zpět do kapaliny. Objem kapaliny se proto zmenšuje a současně se zvětšuje hustota a tlak páry nad kapalinou. Po určité době nastane rovnovážný stav, při kterém počet molekul vracejících se do kapaliny je roven počtu molekul kapalinu opouštějících. Objem kapaliny a páry se nemění, konstantní také zůstává tlak páry a teplota soustavy.
Pára, která je v rovnovážném stavu se svou kapalinou, se nazývá sytá pára. Tlak syté páry nezávisí při stálé teplotě na objemu páry. Zvětší–li se objem prostoru nad kapalinou, pak se část kapaliny vypaří a tlak syté páry dosáhne původní hodnoty. Pro sytou páru neplatí stavová rovnice ideálního plynu. Tím se sytá pára podstatně liší od ideálního plynu. Z pokusů dále vyplývá, že tlak syté páry nad kapalinou s rostoucí teplotou roste. Zvýšíme–li teplotu kapaliny, část kapaliny se vypaří, čímž vzroste hustota molekul syté páry a tím i tlak.
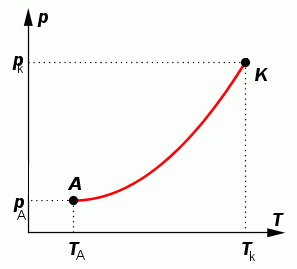
Křivka syté páry - graf závislosti tlaku syté páry na teplotě.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Tato křivka se pro jednotlivé látky liší. Každý bod křivky syté páry odpovídá jedinému rovnovážnému stavu syté páry a kapaliny. Tento stav je jednoznačně určen teplotou a tlakem. Bod A odpovídá nejmenší hodnotě teploty a tlaku, kdy spolu existují v rovnovážném stavu sytá pára a kapalina. Bodu K (kritický bod) odpovídá teplota Tk tzv. kritická teplota, při které je hustota kapaliny rovná hustotě syté páry. Vymizí mezi nimi rozhraní. Z křivky syté páry získáme další informaci a to teplotu varu kapaliny při daném tlaku.
Jestliže sytou páru zahříváme nebo izotermicky zvětšujeme její objem bez přítomnosti kapaliny, vznikne přehřátá pára. Přehřátá pára je pára, která má vždy nižší tlak a hustotu než sytá pára téže teploty. Pro přehřáté páry, platí přibližně stavová rovnice ideálního plynu.
