Dosáhne–li krystalická látka určité teploty, mění se v kapalinu. Jev se nazývá tání. Teplota, při které nastává tání pevné látky, se nazývá teplota tání, která je různá pro různé látky. Protože teplota tání závisí na tlaku, udává se v tabulkách tzv. normální teplota tání, tj. teplota tání za normálního tlaku. Nejvyšší teplotu tání za normálního tlaku má wolfram 3 370 °C naopak jednu z nejnižších má např. rtuť –39 °C. Teplotu tání dané látky můžeme snížit přidáním příměsi, např. slitina cínu (teplota tání 232 °C) a olova (327,3 °C) taje při teplotě 240 °C. Dalším příkladem je přidání soli v zimě na zmrzlý led na chodníku. Tím se sníží jeho teplota tání a při okolní teplotě nižší než 0 °C začne led tát. Látky amorfní a směsi přecházejí při zahřívání v kapalinu postupným měknutím. Nemají tedy určitou teplotu tání. Stálá hodnota teploty tání je dobrou kontrolou chemické čistoty látky.
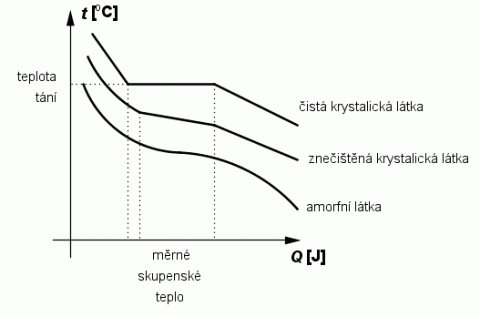
Závislost teploty látky na dodaném teple při tání/tuhnutí u krystalických a amorfních látek.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Teplo potřebné k tomu, aby se pevná látka o hmotnosti m zahřátá na teplotu tání přeměnila v kapalinu stejné hmotnosti a teploty, nazýváme skupenské teplo tání Lt. Po vydělení skupenského tepla tání hmotností tělesa dostaneme měrné skupenské teplo tání.
![]()
Jednotkou této veličiny je J kg–1. Je to energie potřebná na rozrušení molekulových vazeb pevného skupenství. Poměrně vysokou hodnotu měrného skupenského tepla tání má led. Důsledkem je pak pomalé tání ledu a sněhu na jaře.
Přijímá–li krystalická látka teplo, vzrůstá střední kinetická energie kmitavého pohybu částic. Částice zvětšují rozkmity, a tím se zvětšuje i střední vzdálenost mezi nimi. V důsledku toho vzrůstá i střední potenciální energie částic. Dosáhne–li látka teploty tání, nabývají rozkmity částic takových hodnot, že se narušuje vazba mezi částicemi mřížky. Mřížka se začne rozpadávat, látka taje. V různých krystalických látkách jsou vazebné síly mezi částicemi různě veliké. Proto každá látka začne tát za daného vnějšího tlaku při zcela určité teplotě.
U většiny látek roste při zvýšení tlaku také teplota tání. Tyto látky také při tání zvyšují svůj objem a při tuhnutí ho zmenšují. Např. relativní zvětšení objemu při tání olova je asi 3,4 %. Některé látky, např. led, antimon, bismut a některé slitiny, naopak s rostoucím tlakem snižují teplotu tání. Kus ledu je možno proříznout ocelovým drátem zatíženým závažím (tzv. regelace ledu). Led pod drátem taje, ale vzniklá voda hned tuhne, takže drát projde ledem, aniž jej rozdělí. Regelací vysvětlujeme plastičnost tajícího sněhu, který tlakem snadno přijímá různé tvary, pohyb ledovců apod. Stejná vlastnost ledu umožňuje bruslení. Díky tenké čepeli brusle působíme na led velkým tlakem, který snižuje teplotu tání ledu např. na –5 °C. Pod bruslí se vytvoří tenká vrstvička roztáté vody, po které snadno kloužeme. Látky, které s rostoucím tlakem snižují svou teplotu tání, zmenšují při tání objem a při tuhnutí jej zvětšují. Např. u ledu činí relativní změna objemu asi 9 %. V puklině horniny zmrzlá voda zvětšením objemu vyvolá velké tlakové síly, které horninu roztrhnou (mrazová eroze). Podobnou vlastnost mají i slitiny. Proto se musí forma na odlévání dělat asi o 1 % větší a odlitek při tuhnutí ji dobře vyplní.
Ochlazujeme–li kapalinu vzniklou táním krystalické látky, mění se při teplotě tuhnutí (u krystalických látek rovné teplotě tání) v pevné těleso. Při tuhnutí odevzdává těleso do okolí skupenské teplo tuhnutí rovné skupenskému teplu tání. Tento jev můžeme pozorovat např. jako oteplení pár minut před sněžením.
Jestliže kapalina vzniklá táním krystalické látky odevzdá skupenské teplo tuhnutí okolním chladnějším tělesům, začnou se v ní vytvářet vlivem vazebních sil krystalická jádra. K nim se připojují a pravidelně uspořádávají další částice látky. V tavenině vznikají krystalky, které při ztuhnutí látky vytvářejí zrna – vzniká polykrystalická látka. Vytvoří–li se v tavenině pouze jeden zárodek, vznikne krystalizací monokrystal. Při technické přípravě monokrystalů se používá malý monokrystal téže látky jako krystalizační zárodek. Jestliže ho vnoříme do taveniny a pomalu vytahujeme, pak z taveniny vyroste monokrystal větších rozměrů. Musíme ale zajistit dostatečný odvod energie na rozhraní pevného a kapalného skupenství.
Čisté látky lze přechladit, tj. ochladit kapalinu na teplotu nižší než je teplota tání. K tuhnutí dojde ve chvíli, kdy se v kapalině objeví sebemenší krystalek. Kapalina se nachází v metastabilním stavu. Značně přechlazená kapalina ztuhne pouhým nárazem nebo stykem s kapalinou jinou. Vodu zbavenou vzduchu lze přechladit na teplotu -40 °C aniž zmrzne.
Když tělesná teplota organismu klesne pod bod mrazu, pak voda v organismu vytvoří ledové krystalky, které protrhnou buňky a způsobí tak smrt. Existují však živočichové, kteří se s teplotami pod nulou dokáží vyrovnat. Nejznámějším nemrznoucím živočichem je skokan lesní (Rana sylvatica), který vydrží teploty až -14 °C. Aby se skokan ubránil chladu, tak se mu v krvi tvoří látky, které brání vzniku ledových krystalků. Dalším mechanismem, který využívají třeba antarktičtí pakomáři (Belgica antarctica), je zbavení organismu vody. Jediným savcem, který dokáže přežít, i když teplota jeho těla klesne na velmi nízkou hodnotu (při hybernaci až -3 °C, je sysel Parryův (Spermophilus parryii). Jaký mechanismus využívá není zatím známo.

Sysel Parryův.
Zdroj: commons.wikimedia.org. Autor: Ianaré Sévi. Under Creative Commons.
