Tento zákon objevil Joseph Gay–Lussac a zveřejnil ho v roce 1802 ve spisu Recherches sur la dilatation des gaz et des vapeurs.
Jestliže v nádobě zajistíme konstantní tlak, pak se daný děj nazývá izobarický, tzn. že platí p1 = p2. Pak stavovou rovnici dostaneme ve tvaru
![]()
neboli
![]()
Při izobarickém ději s ideálním plynem stálé hmotnosti je objem plynu přímo úměrný jeho termodynamické teplotě. Grafické znázornění závislosti objemu plynu na jeho termodynamické teplotě při izobarickém ději se nazývá izobara.
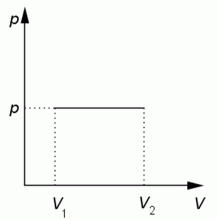
Grafická závislost tlaku na objemu.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Při zvýšení teploty plynu přijme plyn teplo. Protože při izobarickém zvětšení objemu plyn koná práci, vyplývá z prvního termodynamického zákona, že teplo přijaté ideálním plynem při izobarickém ději se rovná součtu přírůstků jeho vnitřní energie a práce, kterou plyn vykoná. Práce odpovídá obsahu obdélníku pod izobarou.
Izobarický děj se vyskytuje např. při ohřívání a ochlazování vzduchu ve výměnících tepla a při hoření paliva během vstřikování do válce u spalovacích motorů, v plynových turbínách nebo proudových motorech.
Za předpokladu, že T0 = 273,16 K a T = 273,16 + t, můžeme Gay–Lussacův zákon přepsat takto

Tento vztah vyjadřuje závislost objemu plynu na teplotě v celsiových stupních. Koeficient 1/273 je pro všechny plyny stejný.

